 对照组,在外科手术时取下肢多余的皮肤,HE染色观察并比较糖尿病足病溃疡边缘皮肤结构的改变。现报道如下。
对照组,在外科手术时取下肢多余的皮肤,HE染色观察并比较糖尿病足病溃疡边缘皮肤结构的改变。现报道如下。
1 资料与方法
1.1 一般资料 2014年6月-2016年5月在本院住院及门诊就诊糖尿病足溃疡患者227例。本研究获得医院伦理学委员会批准。入选标准:(1)符合1999年世界卫生组织WHO糖尿病诊断标准:①有典型糖尿病症状,空腹血糖≥7.0 mmol/L(126 mg/dL),或随机血糖≥11.1 mmol/L(200 mg/dL);②无典型症状,仅空腹血糖≥7.0 mmol/L(126 mg/dL),或随机血糖≥11.1 mmol/L(200 mg/dL),再重复一次仍达到上述指标;③75 g葡萄糖负荷后2 h血糖≥11.1 mmol/L。
空腹的标准是在采血标本前至少禁食8 h以上。
(2)足部出现溃疡和/或深层组织破坏。(3)自愿参加并签署知情同意书。排除标准:(1)合并慢性肾功能衰竭(尿毒症前期或尿毒症期);(2)合并肝功能不全和/或急慢性活动性肝炎;(3)合并其他内分泌或代谢性疾病;(4)合并自身免疫性疾病、血液疾病或恶性肿瘤;(5)存在免疫缺陷;(6)需要口服或吸入性糖皮质激素治疗;(7)存在重大创伤;(8)妊娠、哺乳患者。
1.2 方法
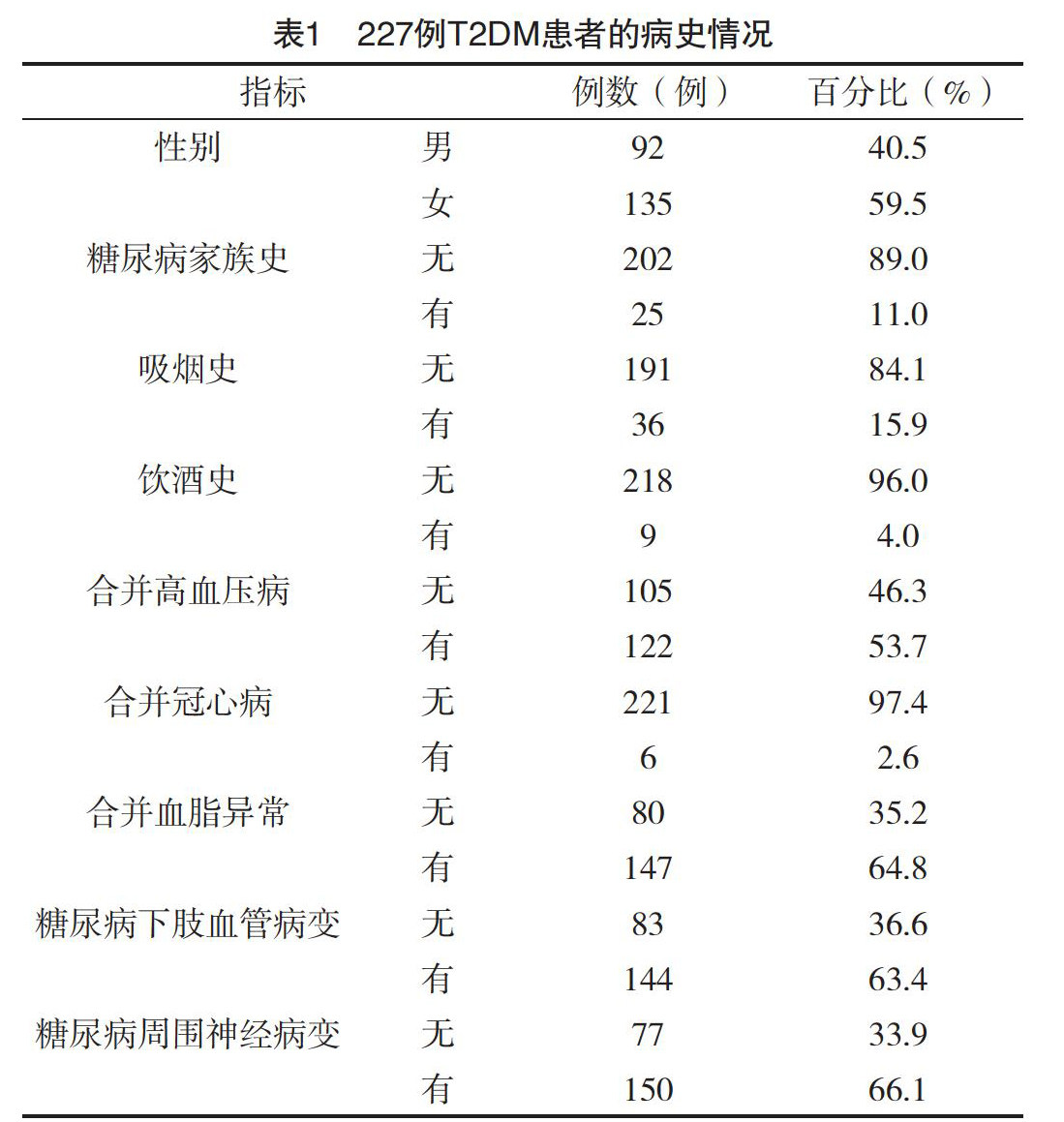
1.2.1 病史回顾调查 包括患者的性别、年龄、糖尿病病程、糖尿病家族史、吸烟史、饮酒史、高血压病史、冠心病病史、高脂血症病史。
1.2.2 入选后检查 患者足部溃疡的严重程度按Wagner分级法进行。足局部检查包括足局部皮肤颜色、胼胝、溃疡。周围神经检查内容为膝、踝反射,音叉振动觉、10 g尼龙丝检查、震动感觉阈值(VPT)测定:使用Semsiometer A200数字震动感觉阈值检查仪对患者双足大脚趾前端(趾腹中心距前端趾甲2.5 cm处)进行VPT检查,VPT结果在10~15 V为病变临界区域,16~24 V为轻中度病变,>25 V为严重病变。双下肢动脉彩色多普勒超声检查:包括双下肢股总动脉、股深动脉、股浅动脉结、腘动脉、胫前动脉、胫后动脉及足背动脉。下肢血管病变诊断标准:(1)动脉内膜厚度≥1 mm;(2)动脉内膜不厚但回声增强;(3)斑块形成(单发、多发、弥漫);(4)管径狭窄。满足以上4个标准中任一标准即可诊断下肢动脉硬化。
1.2.3 实验室检查 收集患者入院前最后一次门诊静脉血检查结果,或入院后首次静脉血检查结果,记录血常规、空腹血糖(FPG)、空腹C肽(fasting C peptide)、餐后2 h C肽,糖化血红蛋白(HbAlc)、总胆固醇TC)、总甘油三脂(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、尿素氮(BUN)、血肌酐(Cr)、尿酸(UA)、超敏C反应蛋白 (hs-CRP)。估計肾小球滤过率(eGFR):采用MDRD公式计算,eGFR=186×(SCr)-1.154×(年龄)-0.203×(×0.741女性)×(×1.233中国人)。
1.2.4 分组 糖尿病足组:调查期间共227例糖尿病足患者,随机抽取20例,取糖尿病足溃疡边缘皮肤做皮肤组织学观察。正常对照组:在骨科及整形外科收集非糖尿病外伤10例患者作为正常对照组,在外科手术时取下肢多余1 cm×1 cm大小的皮肤。
1.2.5 皮肤组织标本的采集、处理及HE染色 使用无菌手术刀或手术剪对糖尿病足病皮肤溃疡边缘部分正常皮肤组织行皮肤全层取材,约0.5 cm×1 cm,去除皮下脂肪组织,立即放入4%多聚甲醛中固定,于48 h内制成蜡块保存,用于HE染色;取非糖尿病外伤患者在外科手术时取下肢多余1 cm×1 cm大小的皮肤组织,去除皮下组织后同上保存。固定好的皮肤组织经全自动脱水机脱水后,石蜡包埋,切成4 μm厚的组织切片,HE染色,Nikon显微数码系统拍照观察皮肤结构。
1.3 统计学处理 使用SPSS 19.0统计软件对所得数据进行统计分析,计量资料,以Kolmogorov-Smirnov检验进行正态性检验,服从正态分布用(x±s)表示,组间比较比较采用t检验。不服从正态分布以中位数M(25%-75%)表示,组间比较采用非参数检验(Mann-Whitney检验)。计数资料以率(%)表示,比较采用 字2检验。足部溃疡程度Wagner分级与其他测定参数间的相关性采用Pearson相关分析及多元逐步回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 糖尿病足病患者一般情况及实验室指标 本研究共纳入糖尿病足患者227例,糖尿病足病患者一般情况,见表1。根据(2013年)中国2型糖尿病防治指南建议的糖尿病患者控制目标[1],纳入研究的糖尿病足患者中收缩压达标159例(70.0%),舒张压达标103例(45.4%),BMI达标139例(61.2%),空腹血糖达标35例(15.4%),餐后血糖达标29例(12.8%),HbA1c达标19例(8.4%),TC达标率53例(23.3%),TG达标134例(59.0%),男性患者HDL-C达标47例(51.1%),女性患者HDL-C达标64例(47.4%),未合并冠心病糖尿病足患者LDL-C达标率12.2%,合并冠心病患者达标率16.7%。见表2。
2.2 糖尿病足发生的Logistic回归分析 对单因素分析中与糖尿病足溃疡可能相关的因素,性别、年龄、糖尿病病程、DM家族史、合并高血压病、收缩压、HbA1c、Hb、eGFR、红细胞压积、尿蛋白进行多因素二项Logistic逐步回归分析,表明年龄、糖尿病病程、HbA1c为显示影响足部溃疡程度Wagner分级的显著因素;其中HbA1c的影响最大(OR=1.278);Hb为T2DM发生糖尿病足的保护因素(OR=0.960)。见表3。
2.3 皮肤HE染色观察 糖尿病足病组皮肤与正常皮肤比较具有典型组织学改变,光镜下可见糖尿病足患者溃疡伤口边缘皮肤真皮乳头层内血管数量明显减少,成纤维细胞数量减少且方向紊乱,胶原稀少且排列紊乱,部分变形、断裂,部分可见炎性细胞浸润,见图1。
3 讨论
目前研究已证实,年龄、病程及血糖是糖尿病足病发生的危险因素。Hasan等[4]研究表明,血糖控制不良与糖尿病足病密切相关。提示良好血糖控制对预防糖尿病足病有积极作用。本研究资料显示,糖尿病足患者227例中,合并高血压病122例(53.7%),合并血脂异常147例(64.8%),存在下肢血管病变144例(63.4%),存在周围神经病病变150例(66.1%)。根据(2013年)中国2型糖尿病防治指南建议的糖尿病患者控制目标[2],该组糖尿病足患者空腹血糖达标率仅15.4%,餐后血糖达标率12.8%,HbA1c达标率仅8.4%,TC达标率23.3%、未合并冠心病糖尿病足患者LDL-C达标率12.2%,合并冠心病患者达标率16.7%。可见,糖尿病足病患者多合并高血压、血脂异常;且存在外周血管病变及周围神经病变;具有年龄大、病程长及血糖血脂水平控制不佳的特点。糖尿病下肢血管病变患者由于组织灌注不良、发展导致缺血性溃疡和坏疽,超过1/3的患者最终需要截肢(趾)。下肢动脉粥样硬化与糖尿病足发生发展有关,下肢动脉粥样硬化可导致管腔狭窄或阻塞,进而引起缺血性溃疡、局部感染和微循环障碍。同时,神经病变则导致肢体末梢的保护感觉减弱或丧失及足部生物力学改变,易引起机械或温度性损失,一旦受损后因血管病变,肢端循环障碍等又使其不易修复[5]。
本研究中年龄是T2DM发生足溃疡的独立危险因素,随着年龄增大,因衰老、凋亡机制,机体整个生理储备和循环功能将逐渐衰退。Imai等[6]对周围神经研究发现,老年较中青年周围神经传导潜伏时间延长,传导速度减慢,波幅逐渐降低,提示老年神经传导功能减退。本研究中HbA1c是T2DM发生糖尿病足溃疡深度的独立危险因素,67.8%入组的糖尿病足患者HbA1c>7.0%,可见长期持续的血糖升高是DPN发生是危险因素。已有研究表明波动性高血糖增加糖尿病周围神经病变的發生风险和严重程度,且在高HbA1c水平使表现更为明显[7]。糖尿病患者长期处于高血糖状态,神经细胞因渗透压改变而肿胀,容易在解剖狭窄部位发生卡压,从而发生神经细胞变性[8]。高血糖可通过多元醇通路损伤神经纤维,也可通过肌醇途径损伤神经纤维,长期高血糖状态下,细胞内山梨醇和果糖堆积使渗透压升高,神经纤维发生节段性脱髓鞘、轴突变性坏死。高血糖状态下,葡萄糖分子的羧基与蛋白质的氨基通过一系列的反应形成复杂的糖基化终产物(advanced glycosylation end products,AGEs)。AGEs广泛沉积于神经营养血管,使管壁增厚、管腔狭窄甚至闭塞,导致神经纤维缺血、缺氧;局部血流灌注不足和神经缺氧,打破了神经微循环血管舒缩功能的平衡,导致神经组织缺血、缺氧以及神经组织的结构和功能损伤[9]。
多因素二项Logistic回归分析结果显示Hb是T2DM发生糖尿病足溃疡的保护因素,DM合并贫血时,血管发生选择性收缩,血流出现再分布,加重原来的神经纤维低灌注和缺氧,加快神经变性坏死。贫血促进氧化应激,可能是由于贫血导致红细胞抗氧化物质缺失,包括超氧化歧化酶、过氧化氢酶和其他抗氧化蛋白产生减少[10],而氧化应激可通过诱导神经组织细胞凋亡而对神经组织的结构功能造成损伤[11]。Hokkam[12]研究300名糖尿病患者发生糖尿病足病的危险因素时发现贫血是糖尿病周围神经病变的独立危险因素。糖尿病皮肤软组织并发症发生机制复杂,而缺血缺氧是其共同特点[13]。缺血缺氧诱导后新生血管生成障碍是糖尿病皮肤软组织再生修复障碍的主要原因之一[14]。可见糖尿病足患者预防治疗过程中应重视血红蛋白水平的影响。
临床观察发现,糖尿病患者足部溃疡形成后,创口往往迁延不愈,反复发作。近年研究发现病程长的糖尿病皮肤在足部溃疡发生细胞、基质、组织等改变,在此期间,诸多细胞因子失衡,从而引发一系列皮肤“隐形损害”[15]。糖尿病皮肤“隐形损伤”是指一种未造成皮肤结构完整性及连续性破坏的损伤,这种损伤是内源性的组织学和细胞功能学的改变,虽不引起皮肤破损或断裂的可见性损伤,但可增加对外源性损伤的易损性。本研究通过HE染色光镜下观察到糖尿病足病组皮肤与正常皮肤比较具有典型组织学改变。光镜下可见糖尿病足溃疡伤口边缘皮肤真皮乳头层内血管数量明显减少,成纤维细胞数量减少且方向紊乱,胶原稀少且排列紊乱,部分变形、断裂,部分可见炎性细胞浸润。这些组织结构的改变与正常皮肤相比有显著不同,这提示糖尿病足病患者足部皮肤存在组织结构的异常改变,导致糖尿病足病患者皮肤抗张力下降而容易损伤,损伤后愈合困难。
糖尿病足病患者多合并高血压、血脂异常;且存在外周血管病变及周围神经病变;血糖血脂控制达标率低。患者年龄大、病程长、血糖控制不佳及贫血与糖尿病足溃疡的发生相关。糖尿病足病组皮肤与正常皮肤比较具有典型组织学改变导致溃疡伤口难愈合。
参考文献
[1] Xu Y,Wang L,He J,et al.Prevalence and control of diabetes in Chinese adults[J].JAMA,2013,310(9):948-959.
[2]中华医学会糖尿病学分会.中国2型糖尿病防治指南(2013年版)[J].中华内分泌代谢杂志,2014,30(10):893-942.
[3] Baltzis D,Eleftheriadou I,Veves A.Pathogenesis and treatment of impaired wound healing in diabetes mellitus:new insights[J].Adv Ther,2014,31(8):817-836.
[4] Hasan R,Firwana B,Elraiyah T,et al.A systematic review and mata-analysis of glycemic control for the prevention of diabetic foot syndrome[J].J Vasc Surg,2016,63(2):22s-28s.
[5] Walker R.Diabetes and peripheral neuropathy:Keeping people on their own two foot[J].Br J Community Nurs,2005,10(1):33-36.
[6] Imai T,Yuasa H,Kato Y,et al.Aging of phrenic nerve conduction in the elderly[J].Clin Neurophysiol,2005,116(11):2560-2564.
[7]姜涛,宋秀霞,张敏,等.波动性高血糖对2型糖尿病患者周围神经病变的影响[J].中国慢性病预防与控制,2010,18(1):54-56.
[8]张文川,钟文翔,杨敏,等.糖尿病病程对糖尿病下肢周圍神经病变的影响[J]. 神经疾病与精神卫生,2013,13(3):257-260.
[9]沈玲玲,任明山.晚期糖基化终产物对糖尿病周围神经病变的作用[J].中国临床神经科学,2011,19(4):428-432.
[10 ]Fibach E,Rachmilewitz E.The role of oxidative stress in hemolytic anemia[J].Curr Mol Med,2008,8(7):609-619.
[11]张倩,梁晓春.氧化应激与糖尿病周围神经病变的研究进展[J].中华内分泌代谢杂志,2015,31(11):1000-1003.
[12] Hokkam E N.Assessment of risk factors in diabetic foot ulceration and their impact on the outcome of the disease[J].Prim Care Diabetes,2009,3(4):219-224.
[13] Matough F A,Budin S B,Hamid Z A,et al.The role of oxidative stress and antioxidants in diabetics complications[J].Sultan Qaboos Univ Med J,2012,12:15-18.
[14] Volarevic V,Arsenijevic N,Lukie M L,et al.Concise review:mesenchymal stem cell treatment of the complications of diabetes mellitus[J].Stem cell,2011,29(1):5-10.
[15]葛小静,姜育智,章宏伟,等.糖尿病皮肤“隐性损害”的机制研究研究进展[J].中华烧伤杂志,2012,28(1):51-53.
(收稿日期:2016-09-20) (本文编辑:程旭然)

